日前,河南省脑靶向生物纳米药物重点实验室一项有关纳米药物诊疗脑胶质瘤的最新研究进展“Brain‐Targeted Aggregation‐Induced‐Emission Nanoparticles with Near‐Infrared Imaging at 1550 nm Boosts Orthotopic Glioblastoma Theranostics”被顶级期刊Advanced Materials在线发表(https://doi.org/10.1002/adma.202106082, IF:30.849)。
脑胶质瘤是颅内最常见的原发性脑肿瘤之一,由于血脑屏障(Blood brain barrier, BBB)的存在,其具有发病率高、复发率高、死亡率高及治愈率低的特点。常见手术、放/化疗对大脑及全身侵害性大,因此亟需发展一种非侵入的安全疗法实现原位脑胶质瘤的治疗,并结合成像示踪技术对治疗过程进行非侵入的实时观测。近日,tyc1286太阳成集团的冰洋教授团队与香港中文大学的唐本忠院士团队、中国科学院长春应用化学研究所的刘顺杰教授团队合作,构建了一种近红外脑靶向聚集诱导发光(AIE)纳米诊疗剂用于脑胶质瘤的近红外成像辅助的非侵入光热治疗。这一成果近期发表在Advanced Materials 上,文章的第一作者是tyc1286太阳成集团副教授王杰菲和硕士研究生刘义升。
脑胶质瘤病灶所处位点深、血脑屏障的存在和头部颅骨的覆盖,对肿瘤治疗和光学成像观测提出了严峻的挑战。目前的小分子化疗药物体内循环时间短、治疗效率差且全身副作用强,同时常见的临床成像方式(CT、MRI等)对身体有一定副作用,不适合长时间多次实时跟踪研究。近红外光热治疗和近红外荧光成像具有作用深度深、非侵入、安全高效的特点,非常适用于深层原位脑胶质瘤的诊疗应用。鉴于大多数荧光分子的光能转换中,荧光和光热是两个互相竞争的能量利用途径,难以同时实现良好的平衡分配。该研究巧妙地利用分子设计和纳米聚集技术,构建了一种具有D-π-A结构的近红外聚集诱导发光(AIE)特性的纳米诊疗剂,该诊疗剂巧妙地集成平面共轭结构和苯环的大位阻效应,提升分子吸收能力的同时保证了光热转化(34%)和荧光的能量流平衡。其高亮的荧光特性允许其在少量的透光量下,首次实现了1550 nm带通滤光片下的体内示踪。将其进一步表面修饰脑靶向多肽(ApoE)后,在808 nm激发和温和的光疗功率下(0.5 W/cm2)实现纳米诊疗剂在原位脑胶质瘤中的1550 nm的示踪和高效近红外光热治疗。
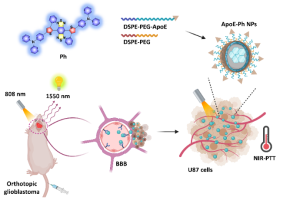
图1. 脑靶向AIE纳米诊疗剂用于原位脑胶质瘤成像和治疗示意图。
所得AIE分子(Ph)在1550 nm处有一定的吸收,纳米化后的AIE颗粒的粒径呈正态分布,将其尾静脉注射进裸鼠体内后,显现出良好的聚集增强的血管成像效果,分辨率可达156 μm。同时得益于其纳米聚集结构,赋予其较好的近红外光(808 nm)热转换性能。
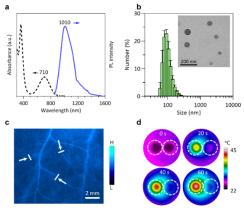
图2. AIE分子的光谱、纳米AIE颗粒的形貌及其近红外血管成像和光热评估。图片来源:Adv. Mater.
在原位脑胶质瘤模型中,该脑靶向AIE纳米诊疗剂(ApoE-Ph NPs)经过尾静脉注射、穿越血脑屏障后,特异性结合到肿瘤细胞表面的低密度脂蛋白受体。相较于非靶向组,靶向组的近红外荧光成像显示较高的入脑量及牢固的结合力。同时30 nm以下的非靶向纳米材料由于尺寸效应也可穿越血脑屏障进入脑内,但由于缺乏特异锚定能力,在48小时被快速代谢出脑。因此靶向组在光照下显示出优于非靶向组的肿瘤抑制效率。
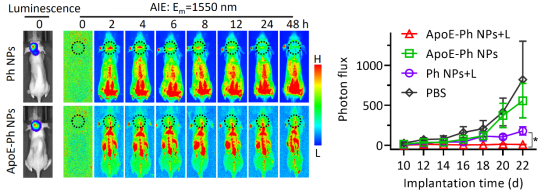
图3. AIE纳米诊疗剂的应用:体内近红外荧光成像(左)和光热肿瘤抑制(右)。
河南省脑靶向生物纳米药物重点实验室主要依托于tyc1286太阳成集团生命科学学院和tyc1286太阳成集团。该实验室筹建于2015年9月,相继获批河南省纳米生物医学国际联合实验室(2016年)、河南省生物纳米医学学科创新引智基地(2018年),并于2020年11月经河南省科学技术厅批准建设河南省重点实验室。实验室专注于脑部疾病的机制研究、新型诊疗系统的开发及脑部疾病靶向治疗,在脑部疾病新治疗靶点的筛选及输送策略机制研究(Nature Communications, 2020, 11, 2978;Advanced Science, 2021, 2102001),脑部诊疗系统开发及应用(Advanced Materials, 2021, 202106082; Biomaterials, 2020, 229, 119576; Small, 2020, 2003654; Small, 2017, 3,1603966),脑部递送系统构建(Advanced Materials, 2019, 1903277; Advanced Materials, 2020, 2000416; Nano Letters, 2020, 20, 1637; Angew. Chem. Int. Ed. 2019, 58, 4938),脑靶向纳米药物临床前评估及转化(Science Advances, 2020, 6, eabc7031; Advanced Materials, 2018, 1803717; Advanced Materials, 2021, 2104779; Biomaterials, 2021, 276, 121036)等领域取得一系列研究成果,同时受邀撰写多篇脑部生物纳米药物相关综述(Trends in Biotechnology, 2018, 36, 562;Advanced Science, 2020, 8, 2101090; Advanced Functional Materials, 2020, 2005029),产生了较大的学术影响力。上述系列成果有效支撑了我校生物学“一流学科”的建设,推动了生物学与相关学科的交叉融合及“生物学+”的发展。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202106082
